水凝胶手性特征的调控及其细胞粘附研究
上海交通大学材料学院、金属基复合材料国家重点实验室研究团队在仿生手性超分子水凝胶材料取得了重要进展:开发了手性可控的超分子水凝胶体系,发现超分子手性自组装结构能够被非手性分子调控,而纳米纤维结构的手性可显著影响细胞、生物分子与材料的相互作用,进一步功能化手性结构则赋予手性自组装结构智能调控细胞行为的功能,该研究不仅能够了解生命体系中立体选择性的起源,而且在生物医药健康等领域有应用价值。该研究成果在 Angew. Chem. Int. Ed上发表论文两篇。
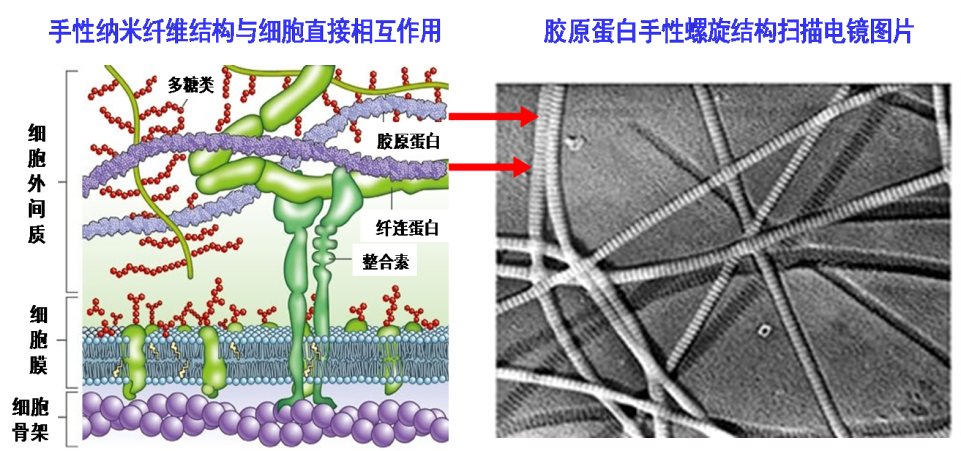
图1、手性纳米纤维与相关的生命活动紧密相连,是细胞生存环境的最主要组成部分之一。
水凝胶是最好的仿生细胞外基质(ECM)之一, 而ECM是支持并连接组织的网架结构,主要调节组织的发生和细胞的生理活动,其中ECM手性特征起到了决定作用,然而关于ECM手性调节组织细胞的研究仍旧处于探索阶段,其影响细胞粘附(图1)、生长的本质和机理仍旧是个亟需解决的关键科学问题,开展相关研究不仅能够了解生命体系中立体选择性的起源,而且在生物医药健康等领域有应用价值。而解决该问题的关键是如何通过设计分子结构以构建具有手性特征的仿生水凝胶材料、研究其与细胞及生物分子的相互作用。
为了解决上述科学问题,几年来我们课题组将可功能化的理念引入到了超分子凝胶分子结构的设计中,构建了系列手性可控、功能可调、智能响应的仿生纳米纤维自组装体。合成了系列基于C2对称的手性超分子凝胶因子,具有模块可设计的特点。该类超分子之间通过刚性核疏水-疏水或π-π、分子臂上氢键的恒定作用进行自组装,不受外侧化学组份的影响,确保了组装的同时,赋予了组装体可功能化的优点。其次,自组装纳米纤维凝胶中水分含量范围广泛,最高可达99.94%,拥有10-80微米多孔结构,满足了细胞生长空间的需求,纳米纤维直径在10-300纳米之间,具有仿生胶原蛋白结构的特征。同时具有力学强度可调控的特征,可满足不同细胞的粘附生长。特别发现了该类手性超分子自组装体手性特征受到非手性分子影响,为探索非手性因素对手性组装影响的机制提供了理论支持,文章发表在Angew. Chem. Int. Ed. (2016, DOI: 10.1002/anie. 201510140R1)上,并被作为封面文章。
基于上述手性自组装体,进一步揭示了手性纳米纤维调控细胞粘附、生长的规律及机理,首次报道了左旋纳米纤维可大大促进细胞的粘附、生长,右旋环境中则抑制细胞的粘附、生长。并通过研究细胞膜基质蛋白与手性纳米纤维的相互作用,揭示了基质蛋白介导细胞粘附、生长的机理。此研究对构建仿生手性微纳米结构提供了理论基础和新思路,初步解决了手性纳米纤维调控细胞粘附、生长等基础科学问题,相关研究发表在Angew. Chem. Int. Ed. 2014, 53, 7789-7793。
上述研究表明开发手性可控的水凝胶体系的可行性,纳米纤维结构的手性可显著影响细胞、生物分子与材料的相互作用,尤其该手性结构可进一步功能化,从而实现调控细胞行为,这对新型生物材料与器件的设计开发有重要意义。对开发仿生手性ECM的应用材料、为组织工程、生物医药的发展提供仿生网架结构的开发提供坚实的理论和技术支持。
该项研究工作得到了国家自然科学基金、973,教育部新世纪优秀人才,上海东方学者,和浦江人才计划等资助。文章第一作者为刘国锋博士,通讯作者为材料学院冯传良教授。
Address: 800 Dongchuan Rd. Minhang District, Shanghai, China Tel: +86 21 54747651
Copyright © 2025 Shanghai Jiao Tong University


